反応が一次で表され,A -> B,及び,B -> C のように変化するのは,実際の反応でも現れることのある例の一つです.
反応を考慮した流体シミュレーションを実際に行って検証することも勿論可能ですが,例えば,A が原料ガスの場合,原料の供給量が十分か,或は,その利用効率は,といった概略を知りたいような場合に,mathematica で微分方程式を連立させて解き,見通しを立てる,といったことが可能です.
species A,B,C の濃度を,cA,cB,cC とすると,釣り合いの式は,以下のように表されます.
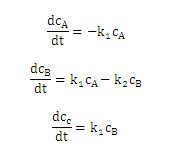
ここで,k1 及び k2 は,A -> B,及び,B -> C へ進む際の反応レートとします.mathematica では,例えば,以下のように記述することが出来ます.なお,便宜的に,k1 = 10,k2 = 20,としています.

mathematica での input の例
時間ゼロの時点では,cA = 10,cB = cC = 0 を仮定します.
計算された各濃度は,以下のようなグラフで示されます.
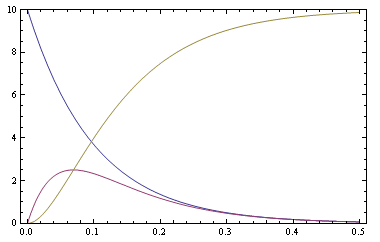
各species の時間に対する濃度(青->cA,赤->cB,黄色->cC)
cA(図中の青線)は時間とともに単調に減少しますが,cB(図中の赤線)は,ピークを持つ様子が示されています.最終生成物の cC(図中の黄色線)は,単調に増加してある程度の時間が経過すると飽和します.
このように,連立微分方程式を解いてグラフ化するのに数行で済む点は,mathematica の良さの一つと言えます.
☆
back to home > support > mathematica_tips
© 2008- ATHENASYS Co., Ltd. All Rights Reserved.
